商务部:口罩白名单申请渠道来了!附申请材料及要求

商务部发布通知,防疫物资生产企业可以向本地商务局申请加入商务部白名单,并提交相关表格和证明材料。

为做好《商务部 海关总署 国家市场监督管理总局关于进一步加强防疫物资出口质量监管的公告》(2020年第12号)的落实工作,现就审核确认符合国外标准认证或注册的防疫物资生产企业名单有关工作通知如下:
请各地方商务主管部门组织本地防疫物资生产企业自愿填报有关表格并提交相关证明材料(非医用口罩生产企业填写附件1,医用口罩等5类医疗物资生产企业填写附件2)。地方商务主管部门会同本地医疗物资商业出口工作机制有关成员单位初步审核后,以工作机制办公室名义(本地商务主管部门代章)将汇总表(含电子版)统一报送至国家医疗物资商业出口工作机制办公室(商务部外贸司),同时抄送中国医药保健品进出口商会。原则上每周报送一次,截止时间为每周三17:00。
非医用申请:
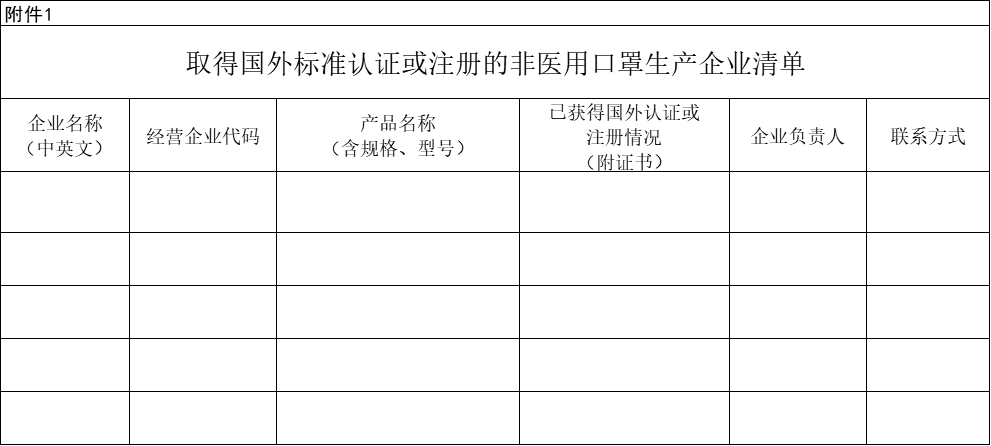
填写说明:
1. 填报范围仅限于获得国外认证或注册的非医用口罩;
2. 请按产品填写,每个产品一行;
3. 企业名称”栏请务必填写中英文名称,同一家企业的多个产品请依次填写,企业名称列不合并单元格;
4. 产品名称”请列明中英文具体名称、规格、型号等;
5. 请务必提交本表中已填写的国外认证关键材料扫描版,包括认证证书、检测报告等,并以证书名称命名该文件;
6. 相关文件请统一放置到一个文件夹中,文件夹以企业中文名称命名, 相关资质文件命名方式为:序号+企业中文名称缩写+产品名称+证书或检测报告名称;
医用申请:

填写说明:
1. 填报范围仅限于五大类医用物资,即新冠病毒检测试剂、呼吸机、医用防护服、医用口罩、红外体温计;
2. 请按产品填写,每个产品一行;
3. “企业名称”栏请务必填写中英文名称,同一家企业的多个产品请依次填写,企业名称列不合并单元格;
4. “产品名称”请列明中英文具体名称、规格、型号等,并注明无菌或非无菌;
5. 同一产品出口不同国家(地区),请在“进口国(地区)”单元格中合并填写,无须每个国家一行;
6. 请务必提交本表中已填写的国外认证和注册文件,在“资质文件”列的同一个单元格中按序号列明;
7. 本表格中已填写的“资质文件”,请统一放置到一个文件夹中,文件夹以企业中文名称命名,
相关资质文件命名方式为:序号+企业中文名称缩写+产品名称+证书或检测报告名称,序号请务必与表格中“资质文件”列的序号相同;
8. 其他:原则上产品出口应满足进口国标准,如未在进口国注册,请提供对方国授权进口许可的相关证明文件并在合同中约定。
以上为白名单申请渠道及方式。
不在白名单中的照旧可出口,
出口的非医用口罩应符合国内外标准。
加强了出口要求,保证质量过关。
End.
附出口所需资料及要求
非医用口罩出口资料所需:
- 发票箱单
- 箱单
- 报关委托书
- 非医用出口方和进口方共同声明
- 非生产企业出口的,双抬头报关,境内发货人经营单位,生产销售单位生产企业,提供生产企业给经营单位的委托声明。
- 用于赠与亲朋好友客户的,报其他进出口,免费,提供说明。
-
报关单
医用口罩出口资料所需:
报关单
发票
箱单
报关委托书
器械注册证
出口医疗物资声明
非生产企业出口的,须双抬头报关,境内发货人报经营单位,生产销售单位报生产企业,提供生产企业给经营单位的委托声明。
用于赠与亲朋好友客户的,报其他进出口,免费,提供说明。
外包装方面要求:
包装不能简陋的透明袋包装,
需彩色袋子及纸盒包装,且标明用途医用或者非医用
合格证方面要求:
生产厂家
生产地址
品名(非医用需标明)
执行标准(国家标准)
生产日期和有效期
生产批号
具体成分含量
医疗器械注册证号(医用需提供)且盖章
仅供参考,具体出口按当地海关为准。